- Автор Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:24.
- Акыркы өзгөртүү 2025-01-23 12:25.
Эгерде сизде мезгилдик таблица түшүнүксүз жана түшүнүксүз болсо, кабатыр болбоңуз, сиз жалгыз эмессиз! Мезгилдик таблицанын кантип иштээрин түшүнүү кыйын болушу мүмкүн, бирок аны окуганды үйрөнүү менен сиз илимде ийгиликтүү болосуз. Мезгилдик таблицанын структурасын жана элементтер жөнүндө көрсөткөн маалыматты түшүнүүдөн баштаңыз. Андан кийин, сиз элементтердин ар бирин изилдей аласыз. Акырында, атомдогу нейтрондордун санын билүү үчүн мезгилдик таблицада көрсөтүлгөн маалыматты колдонуңуз.
Кадам
3 -жылдын 1 -бөлүгү: Мезгилдик системанын структурасын түшүнүү
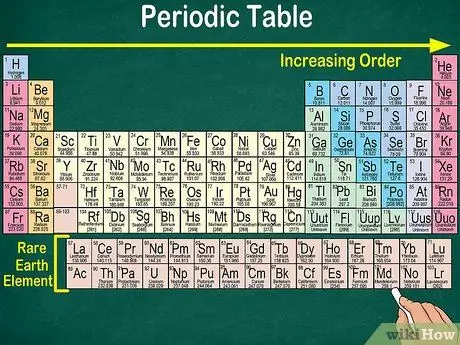
Кадам 1. Мезгил -мезгили менен таблицаны оңдон жогору карай окугула
Элементтер атомдук санына жараша жайгаштырылган. Оңго жана ылдыйга карай канчалык көп болсо, атомдук сан ошончолук жогору болот. Атомдук сан - бул элементтин атомунда бар протондордун саны. Оңго карай барган сайын, ар бир атомдун массалык саны көбөйгөнүн байкайсыз. Башкача айтканда, элементтин салмагын столдогу жайгашкан жерине карап деле түшүнө аласыз.
- Оңго же ылдыйга карай, элементтин атомдук массасы көбөйөт, анткени атомдук масса элементтин ар бир атомундагы протондор менен нейтрондорду кошуу менен эсептелет. Протондордун саны элемент менен көбөйөт, демек анын салмагы да жогорулайт.
- Электрондор атомдук массага кирбейт, анткени протондор менен нейтрондорго салыштырмалуу электрондор атомдук салмакка анча таасир этпейт.

Кадам 2. Ар бир элементтин сол жагындагы атомго караганда 1 протон көбүрөөк экенин түшүнүңүз
Муну атомдук номерге карап айтсаңыз болот. Атом номерлери солдон оңго карай жайгаштырылган. Элементтер да 3 топко бөлүнгөн, сиз таблицада топтоштурууну көрө аласыз.
Мисалы, биринчи катарда атомдук номери 1 болгон суутек жана атомдук номери 2 болгон гелий жазылган. Бирок бул эки элемент столдун эң сол жана оң жагында жайгашкан, анткени алар ар түрдүү топтордо
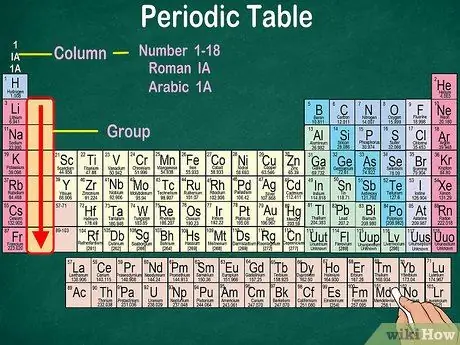
3 -кадам. Физикалык жана химиялык касиеттери бирдей болгон атомдордун топторун аныктаңыз
Топтор вертикалдуу мамычалар менен көрсөтүлөт. Көпчүлүк учурда, топтор бир эле түс менен мүнөздөлөт. Бул кайсы элементтер окшош физикалык жана химиялык касиеттерге ээ экенин аныктоого жардам берет. Бул сизге бул элементтердин реакциясын алдын ала айтууну жеңилдетет. Белгилүү бир топтун ар бир элементи эң сырткы орбиталында бирдей электронго ээ.
- Көпчүлүк элементтер бир гана топко кирет. Бирок, суутекти галоген же щелочтуу металл катары классификациялоого болот. Кээ бир таблицаларда суутек эки топто тең пайда болот.
- Көпчүлүк учурларда, мамычалар үстөлдүн үстү же асты жагында 1-18ге чейин номерленет. Сандар рим цифралары (IA), араб цифралары (1А) же сандар (1) менен көрсөтүлүшү мүмкүн.
- Атомдук топторду жогорудан төмөн карай окуңуз.
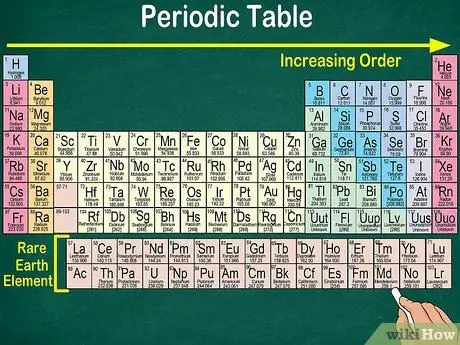
Кадам 4. Таблицанын бош жерине көңүл буруңуз
Атом санынан тышкары, элементтердин топторго жана топторго жайгашуусу ошол эле физикалык жана химиялык касиеттерин да эске алат. Ошентип, сиз ар бир элементтин реакциясын жакшыраак түшүнөсүз. Химиялык элементтердин кошулушу алардын классификациясын татаалдаштырат, андыктан мезгилдик системада бош орун камтылгандыгы таң калыштуу эмес.
- Мисалы, биринчи 3 катарда боштуктар бар, анткени столдо пайда болгон өткөөл металлдар атомдук номери 21 болгон элементтер.
- Ошо сыяктуу эле, сейрек кездешүүчү элементтер же сейрек кездешүүчү элементтер болгон 57ден 71ге чейин столдун төмөнкү оң жагында өзүнчө сүрөттөлөт.
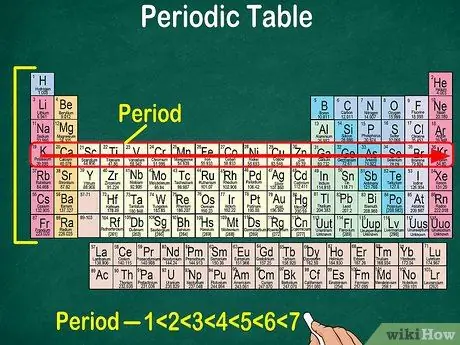
Кадам 5. Ар бир катар мезгил деп аталат
Бир мезгилдеги бардык элементтер бирдей атомдук орбиталдарга ээ, алар аркылуу электрон өтөт. Орбиталдардын саны мезгилдердин санына туура келет. Мезгилдик таблицада 7 катар көрсөтүлгөн, бул 7 мезгил бар экенин билдирет.
- Мисалы, 1 -периоддогу элементтин 1 орбиталы бар, ал эми 7 -периоддо 7 орбиталы бар.
- Көпчүлүк учурларда, столдун сол жагында мезгилдер өйдөдөн ылдыйга чейин 1-7 деп саналат.
- Солдон оңго карай саптан кийинки элементтердин мезгилин окуңуз.
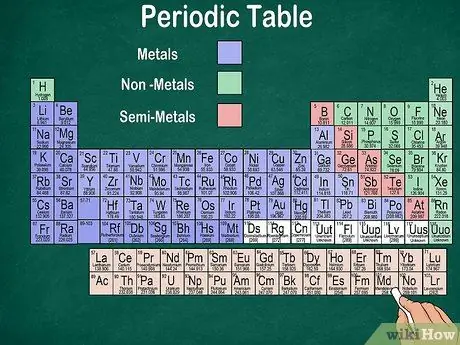
Кадам 6. Металлдарды, жарым металдарды жана бейметалдарды айырмалаңыз
Элементтин түрүн таанып, элементтердин касиеттерин жакшыраак түшүнө аласыз. Бактыга жараша, мезгилдик таблицанын көбү түс металлды, жарым металды же металл эместигин көрсөтүү үчүн колдонот. Сиз столдун оң жагында металл элементтерин, сол жагында металл эместерди таба аласыз. Жарым металл тобу металлдар менен металл эместердин ортосунда жайгашкан.
- Водородду касиеттери боюнча галогендер же щелочтуу металлдар менен топтоштурууга болорун унутпаңыз. Ошондуктан, суутектин үстөлдүн эки тарабында пайда болушу же башка түстө болушу табигый нерсе.
- Элемент металл деп аталат, эгер ал жалтырак, бөлмө температурасында катуу, жылуулукту жана электр энергиясын өткөрсө жана жумшак жана ийкемдүү болсо.
- Элемент металл эмес деп эсептелет, эгер ал жалтырабаса, жылуулукту же электрди өткөрбөсө жана катуу болсо. Бул элементтер адатта бөлмө температурасында газ түрүндө болот, бирок ошондой эле белгилүү бир температурада катуу же суюк болушу мүмкүн.
- Эгерде элемент металл менен металл эместин бириккен касиеттерине ээ болсо, элемент жарым металл деп аталат.
3төн 2 бөлүк: Элементтерди изилдөө
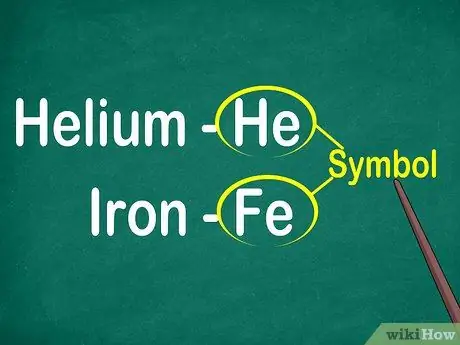
Кадам 1. 1ден 2 тамгага чейин элементтердин символдорун аныктаңыз
Символ, адатта, чоң шрифти бар квадраттын борборунда жайгашкан. Символдар - бул ар кандай тилдерде стандартташтырылган элементтердин аталыштарынын кыскартылышы. Эксперименттерди жасоодо же элементтик теңдемелердин үстүндө иштөөдө, балким, элементтердин символдорун колдоносуз. Ошондуктан, кааласаңыз да, каалабасаңыз да, негизги белгилер менен таанышууңуз керек.
Символдор көбүнчө элементтин латынча аталышынан келип чыгат, бирок кээде кеңири колдонулган аттардан, айрыкча жаңы элементтерден келип чыгат. Мисалы, гелийдин символу-бул белгилүү ысымды туюнткан Ал. Бирок, темирдин символу Fe болуп саналат, аны биринчи көргөндө салыштыруу кыйын

Кадам 2. Эгерде бар болсо, элементтин толук атын табыңыз
Бул толук жазууга туура келсе, колдонула турган элементтин аты. Мисалы, "Гелий" жана "Көмүр" элементтердин аталыштары. Көпчүлүк учурларда, элементтин аталышы символдун астында, бирок жайгаштыруу ар кандай болушу мүмкүн.
Кээ бир мезгилдүү таблицаларда толук аталышы камтылбашы жана символдорду гана колдонушу мүмкүн
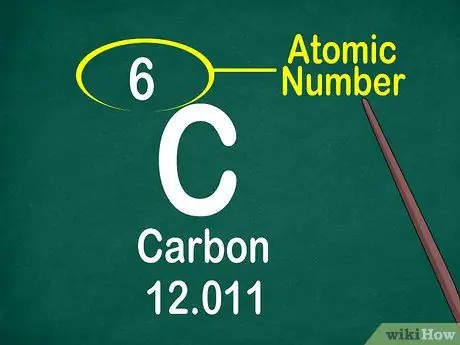
3 -кадам. Атомдук номерге көңүл буруңуз
Атомдук номер адатта кутучанын жогору жагында, кутунун ортосунда же бурчунда жайгашкан. Бирок, атомдук номерди элементтин символу же элементтин аталышы астында да жайгаштырса болот. Атомдук номерлер 1-118ге чейин заказ кылынат.
Атомдук номер ондук эмес, бүтүн сан
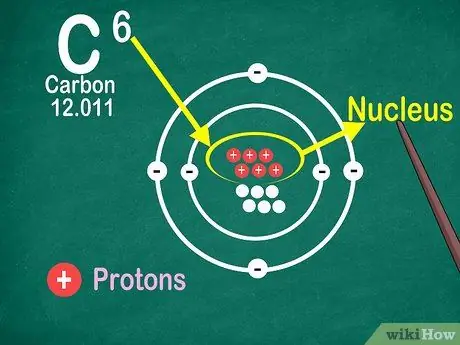
Кадам 4. Атомдук номер атомдогу протондордун саны экенин билиңиз
Элементтин бардык атомдорунда протондордун саны бирдей. Электрондордон айырмаланып, протондорду атомдор кармап же кое албайт. Атомдор атомдорду кармап же жоготуп алса, элементтер өзгөрөт.
Электрон менен нейтрондун санын билүү үчүн сизге атомдук номур да керек
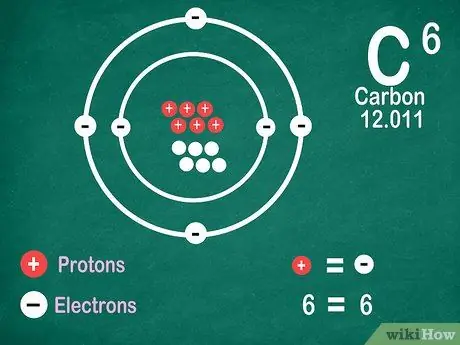
5 -кадам. Элементтер иондошпосо, протондордой эле электрон бар экенин билиңиз
Протондор оң зарядга ээ, ал эми электрондор терс зарядга ээ. Нейтралдуу атомдун электрдик заряды жок болгондуктан, ал электрон менен протондордун бирдей санына ээ экенин билдирет. Бирок, атомдор электронун жоготуп, ээ боло алышат, бул аларды иондоштурат.
- Иондор - электрдик заряддар. Эгерде иондо протондор көп болсо, заряд оң болот, бул иондун символунун жанында оң (+) белгиси. Эгерде иондогу электрондордун саны көп болсо, заряд терс, бул терс (-).
- Атом ион болбосо, сиз оң же терс белгини көрө албайсыз.
3төн 3 бөлүк: Нейтрондорду эсептөө үчүн атомдук салмакты колдонуу

1 -кадам. Атомдук салмагын билиңиз
Атомдук салмак көбүнчө кутунун түбүндө, элементтин символунун астында жайгашкан. Атомдук салмак - атом ядросундагы бөлүкчөлөрдүн, анын ичинде протондор менен нейтрондордун бириккен салмагы. Бирок, иондор эсептөө процессин татаалдаштырышы мүмкүн. Ошентип, атомдук салмагы элементтин орточо атомдук массасын жана анын иондорунун атомдук массасын көрсөтөт.
- Орточо салмагынан улам, атомдордун көбү ондук түрүндө атомдук салмакка ээ.
- Элементтин салмагы солдон оңго жогорулагандай көрүнгөнү менен, андай эмес.
Кадам 2. Сиз окуп жаткан элементтин массалык санын аныктаңыз
Атомдук массаны тегеректөө менен массалык санды таба аласыз. Бул чындык атомдук салмак иондорду кошкондо бардык атомдук массалардын орточо көрсөткүчү экенин далилдейт.
Мисалы, көмүртектин атомдук салмагы 12,011, ошондуктан 12ге чейин тегеректелген. Ушундай эле темирдин атомдук салмагы 55,847, 56га чейин тегеректелген
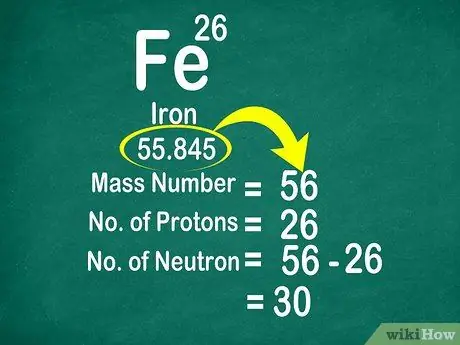
3 -кадам. Нейтрондорду эсептөө үчүн массалык санды атомдук санынан алып салыңыз
Массалык санды нейтрондордун санына протондордун санын кошуу менен эсептесе болот. Бул протондун санынан массалык санды чыгарып, атомдогу нейтрондордун санын эсептөөнү жеңилдетет.
- Бул формуланы колдонуңуз: нейтрон = массалык сан - протон
- Мисалы, көмүртектин массалык саны 12 жана 6 протону бар. Ошентип, көмүрдүн 6 нейтрону бар экенин биле алабыз, анткени 12 - 6 = 6.
- Дагы бир мисал, темирдин массалык саны 56 жана 26 протону бар. Ошентип, темирде 30 нейтрон бар экенин билебиз, анткени 56 - 26 = 30.
- Атомдордун изотопторунда ар кандай санда нейтрондор бар, ошондуктан алардын атомдук салмагы өзгөрөт.
Кеңештер
- Мезгилдик таблицаны окуу кээ бир адамдар үчүн кыйын. Мезгилдик таблицаны изилдөө кыйын болсо, көңүлүңүздү чөгөрбөңүз!
- Таблицанын түстөрү ар кандай болушу мүмкүн, бирок мазмуну ошол бойдон калат.
- Кээ бир мезгилдүү таблицалар толук эмес маалымат бериши мүмкүн. Мисалы, кээ бир столдор символду жана атомдук номерди гана беришет. Ал үчүн муктаждыктарыңызга туура келген столду издеңиз!






